4.1. Элементы теории растворов электролитов.
Сольватация. Электролитическая диссоциация. Элементы теории Дебая - Хюккеля. Коэффициенты активности ионов, ионная сила раствора.
4.2. Электрохимические системы .
Термодинамика окислительно-восстановительных превращений в растворах. Электродные потенциалы. Уравнение Нернста. Типы электродов. Топливные элементы.
216. (1/3-99). Давление HCl над 4 %-м (вес) водным раствором HCl при 25 °С равно 4,4× 10–4 торр. Пользуясь законом Дебая – Хюккеля для предельно разбавленного раствора, оценить давление HCl над 2 %-м (вес) раствором HCl. Молекулярная масса HCl – 36,5.
217. (3/3-94).* В воде растворено некоторое количество нелетучего слабого электролита, не диссоциирующего при низкой температуре, но полностью диссоциирующего на два иона при температурах, близких к температуре кипения воды. Найти температуру кипения данного раствора, если известно, что этот же раствор замерзает при 271,5 К. Учесть, что для чистой воды Δ
Нпл = 6,029 кДж/моль, Тпл = 273,15 К, Δ
Нисп = 40,62 кДж/моль, Ткип = 373,15 К.
Определить давление паров воды над раствором при 299 К, если над чистой водой при 298 К оно
равно 0,03168 бар.
Решение
218. (3/3-00). Равновесное давление H2SO4 над 4 %-м (вес.) водным раствором H2SO4 равно 10–5 торр. Пользуясь соотношениями Дебая – Хюккеля для предельно разбавленного раствора, оценить давление H2SO4 над 2 %-м (вес.) раствором H2SO4. Молекулярная масса H2SO4 98 г.
219. (1/3-03). Константа диссоциации уксусной кислоты в водном растворе при 25 °С равна 1,75 × 10–5 М. Используя первое приближение теории Дебая – Хюккеля, рассчитайте степень диссоциации кислоты, если ее моляльность равна 0,100 моль × кг–1.
Что будет со степенью диссоциации кислоты, если в раствор дополнительно добавят 1 М NaCl?
220. (4/3-01). Среднеионный коэффициент активности растворенной соли АВ дается уравнением
lg g± = –С
где m – моляльность раствора. Выразите коэффициент активности g 1 растворителя через С, D и m. Считать мольную массу растворителя М1, катиона соли МА, а аниона – МВ.
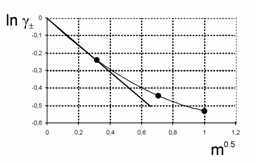
221. (5/Э-06).
Известно, что при температуре 0 ºС среднеионный коэффициент активности
Оценить коэффициент активности воды при m = 0,1 моль / кгводы, исходя из следующих экспериментальных данных:
|
|
0,316 |
0,707 |
1 |
|
|
–0,241 |
–0,443 |
–0,531 |
222. (1/3-06). В 100 см3 раствора HCl с концентрацией 10–3 М растворили 10–3 моль NaCl. Оцените, как изменился рН раствора.
223. (1/3-02). В 1 литр водного раствора легкорастворимого ацетата кальция концентрацией 0,1 М добавили 0,1 моль сульфата калия. Оцените рН полученного раствора, пользуясь следующими термодинамическими данными:
CH3COOH = CH3COO– + H+; Ka = 1,75× 10–5 M;
CaSO4 = Ca2+ + SO42–; ПР = 1,7× 10–5 M2.
224. (1/3-01). Для катионов Tl+ электродный потенциал
225. (1/3-03). Оценить диапазон pH, в котором возможно равновесное преобладание катионов Fe3+ над Fe2+ в 0,01 M водном растворе ионов железа при 25 °С на воздухе.
Стандартный электродный потенциал полуреакции Fe3+ + e– ® Fe2+ cоставляет +0.77 В отн. Н.В.Э., а полуреакции 4 H+ + O2 + 4 e– ® 2 H2O cоставляет + 1,23 В отн. Н.В.Э.
226. (6/2-97). Найти стандартный электродный потенциал для полуреакции Cu2+L + 2e = Cuo + L,
если известны стандартный электродный потенциал полуреакции Cu2+ + 2e = Cuo,Eo = 0,2 B отн. Н.В.Э.
и константа равновесия КС реакции Cu2+ + L = Cu2+L.
При каких pH металлическая медь способна растворяться в водных растворах, содержащих L в концентрации [L] M?
227. (4/Э-07). Найти тепловой эффект процесса окисления метанола 2CH3OH(ж) + 3O2(г) = 2CO2(г) + 4H2O(ж), идущего при 25 ºС в топливном элементе с ЭДС = 1 В. Стандартные энтальпии образования CH3OH(ж), CO2(г) и H2O(ж) равны – 201,0, - 393,51 и – 285,83 кДж/моль соответственно.
228. (4/Э-01). В лабораторной практике широко используют так называемые хлорсеребряные электроды, представляющие из себя серебряную пластину, опущенную в насыщенный раствор хлорида калия; этот раствор соединяется хлорид-анион-проводящим “агар-агаровым” мостиком с раствором, в котором измеряются окислительно-восстановительные потенциалы исследуемых соединений. Найдите аналитическое выражение для потенциала такого электрода относительно Н.В.Э.
229. (1/3-05). Оцените, как изменится потенциал хлорсеребряного электрода (Ag/AgCl) в 0,2 М H2SO4 при изменении концентрации KCl от 10–6 М до 3·10–2 М? Стандартный электродный потенциал для полуреакции AgCl + e– = Ag0 + Cl– равен 0,222 В отн. Н.В.Э.
230. (3/3-02). С использованием нижеприведенных справочных данных о стандартных значениях окислительно-восстановительных потенциалов определите, как изменится выраженное через концентрации ионов Ag+ и Br– произведение растворимости ПР = СAgСBr малорастворимой соли AgBr, если в растворе дополнительно присутствует также NaBr в концентрации 0,01 М.
электрод |
Электродная полуреакция |
Ео, В отн. НВЭ |
Ag+, Ag |
Ag+ + e → Ag |
0,799 |
Ag, AgBr, Br– |
AgBr + e → Ag + Br– |
0,071 |
231. (4/3-05). Возможно ли значительное (экспериментально регистрируемое) окисление металлического серебра в растворе соляной кислоты с pH = 0? Давление водорода в воздухе составляет 5.10–7 атм. Стандартный электродный потенциал для полуреакции: Ag+ + e– => Ag0 составляет 0,799 В отн. Н.В.Э. Стандартный электродный потенциал для полуреакции AgCl + e– = Ag0 + Cl– равен 0,222 В отн. Н.В.Э. Какая концентрация катионов серебра будет в растворе после установления равновесия?
232. (6/Э-00). Э.Д.С. элемента Pb|PbI2|I–||Pb2+|Pb равна 0,1728 В при 25 °С и активностях I– а = 1 М и Pb2+ а = 0,01 М.
Определить растворимость PbI2.
233. (2/3-04). Пользуясь стандартными электродными потенциалами, рассчитайте стандартное изменение потенциала Гиббса D G0 и сделайте вывод о самопроизвольности процесса для реакции:
234. (2/3-07). Ферментативная цепь дыхания заканчивается цитохромоксидазой, переносящей электроны на активированный кислород. Суммарная реакция может быть представлена в виде:
2 [cyt c]– + 0,5 O2 + 2 H+ = 2[cyt c] + H2O,
E0’ (25oC, pH = 7) = + 0,562 В отн. Н.В.Э.
Чему равен стандартный потенциал Гиббса реакции? В какую сторону пойдет реакция при рН = 10 на воздухе?
235. (2/3-99).* Цинковый электрод гальванического элемента Якоби находился исходно
в 10–3 М растворе ионов Zn2+. Найти, как изменится ЭДС этой ячейки при
25 °С, если к раствору Zn2+ добавили такой же объем 10–3 М раствора
ионов Pb2+. Можно полагать, что внутри рассматриваемой части гальванического элемента
термодинамическое равновесие устанавливается очень быстро. Известно, что при 298 К
Решение
236. (5/2-95). ЭДС гальванического элемента Рbç Pb2+ç ç Sn2+ç Sn, составленного из свинцовой пластины в 0,001 М растворе Pb(NO3)2 и оловянной в растворе SnCl2 неизвестной концентрации, равна 0,015 В при 25 °С. Стандартные электродные потенциалы Eo(Sn2+/Sn) = –0,141 B и Eo(Pb2+/Pb) = –0,125 B. Считая растворы идеальными, определить:
а) концентрацию SnCl2;
б) максимальную полезную работу элемента в расчете на 1 моль израсходованного Pb (при условии поддержания концентраций солей постоянными);
в) стандартную ЭДС элемента;
г) используя теорию Дебая-Хюккеля, оценить погрешность в расчете ЭДС элемента вследствие пренебрежения неидеальностью растворов электролитов.
237. (3/3-07). Вы находитесь на косе Тузла, разделяющей Черное (слева) и Азовское моря (справа). Рассчитайте разность потенциалов Елев–Еправ, если для измерения использована: а) пара хлор-серебряных электродов и б) пара Na+ селективных электродов. Содержание NaCl в морской воде составляет 18,5 г и 12,0 г на 1 л воды соответственно. Роль солевого моста выполняет Керченский пролив. Считайте, что минерализация морской воды обеспечивается исключительно хлористым натрием.
238. (2/3-06). Определите ЭДС концентрационного элемента <Pt0/Fe2+,Fe3+//Fe2+,Fe3+/Pt0> при температуре 25 оС, если значение стандартного электродного потенциала E0Fe3+/Fe2+ = + 0?769 В отн. Н.В.Э., в левом электроде концентрация Fe2+ составляет 0,1 М, концентрация Fe3+ составляет 0,01 М; в правом электроде – наоборот: CFe2+ = 0,01 M, а СFe3+ = 0,1 М.
239. (6/3-04). В 10-3 М раствор FeCl2 при 25 оС опустили железный и хлор-серебряный электроды. Оцените ЭДС элемента (Fe|FeCl2,AgClç Ag). Опишите равновесное состояние системы. Стандартные электродные потенциалы составляют:
хлор-серебряного электрода: |
AgCl|Ag0: | E0 = 0,222 В отн. НВЭ, |
железного электрода: |
Fe2+|Fe0: | E0 = – 0,44 В отн. НВЭ |
| Fe3+|Fe2+: | E0 = 0,77 В отн. НВЭ |
240. (6/Э-05). Элемент составлен из двух железоионных электродов (III рода), каждый из которых представляет собой платиновую пластину, погруженную в раствор, содержащий по 0,1 М Fe2+ и Fe3+. Найдите ЭДС элемента после добавления в один из растворов цианистого калия в количестве, достаточном, чтобы создать 2 М раствор CN–. Стандартный электродный потенциал Е0Fe3+/Fe2+ = 0,769 В отн. Н.В.Э. Константы комплексообразования Fe(CN)64– и Fe(CN)63– равны 7,9.10+36 М–6 и 7,9.10+43 М–6, соответственно.
241. (5/Э-02). Произведение растворимости CuCl при 25 °С равно 2,29· 10–7 М2. Определите при этой температуре: а) стандартный электродный потенциал Ео для электрода Cl–ê CuCl(тв)ê Cu(тв); б) стандартный потенциал образования Гиббса для CuCl(тв) (в кДж· моль–1), если известно, что стандартные электродные потен-циалы Ео для полуреакций Cu+ + e– → Cu(тв) и ½ Cl2(г) + e– → Cl–равны соответственно 0,522 В и 1,358 В отн. Н.В.Э.
242. (6/2-98). Найти температурный коэффициент
PbO2(тв) + 2H2SO4 + Pb(тв) = 2PbSO4(тв) + 2H2O,
если он функционирует при 20 °С и массовая доля H2SO4 в электролите 21,4 %. При 20 °С SoH2O(ж) = 69,96 Дж/моль·
К, SoPbSO4 = 148,67 Дж/моль·
К, SoPbO2 = 71,92 Дж/моль·
К, SoPb = 64,80 Дж/моль·
К, SoH2SO4(ж) = 18 Дж/моль·
К. Кроме того известно, что для указанного электролита молярная теплота растворения воды
243. (1/3-08). В стандартном свинцово-кислотном аккумуляторе протекают следующие полуреакции:
Анод: (–) PbSO4 + H+ +2e « Pb + HSO4–,
катод: (+) PbO2 + 3H+ + HSO4– +2e « PbSO4¯ + 2H2O.
Известны стандартные потенциалы:
|
1) PbSO4 + H+ + 2e → Pb + HSO4– |
E10 = –0,356 В отн. НВЭ |
2) PbO2 + 4H+ + 2e → Pb2+¯ + 2H2O |
E20 = +1,455 В отн. НВЭ |
3) Pb2+ + 2e– → Pb0 |
E30 = –0,126 В отн. НВЭ |
Найти ЭДС одной ячейки такого аккумулятора и максимальную возможную работу, совершаемую аккумулятором, в расчете на 1 моль расходуемого свинца при плотности электролита 1,3 г/см3, 25o С. Известно, что концентрация серной кислоты при этом составляет 5,31 М, активность серной кислоты 46,5 M2, активность воды 0,57.
244. (3/3-06).* Произведение растворимости Сu(OH)2 в водном растворе при 25˚оС составляет 2.10–20 М3. Оцените, как будет изменяться электродный потенциал электрода Сu2+/Cu при повышении рН, если исходная активность Cu2+ в растворе при рН = 3 составляла 1,0 М. Стандартный электродный потенциал для полуреакции
Сu2+ + 2e– → Cu0 cоставляет +0,399 В относительно Н.В.Э.
Решение
245. (2/3-00). Никелевый “аллотропический” элемент с электродами из разных кристаллических модификаций металла представляет из себя следующую систему:
a
-Ni ç
Ni2+(C = 0,0012 M) ï
ç
Ni2+(a = 0,0010 M) ç
b
-Ni.
ЭДС такого элемента при 298 К равна –3,3 мВ. Температурный коэффициент ЭДС равен +4,74.10–3 мВ/K. Оценить температуру фазового перехода a
-Ni ®
b
-Ni. Какие дополнительные допущения необходимо сделать для проведения такой оценки? С – концентрация, а – активность.
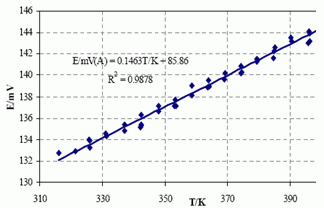
246. (2/3-08).11 Термодинамические свойства реакции
2Ag2Se(тв) + Au(тв) = Ag3AuSe2(тв) + Ag(тв)
определялись в гальванической ячейке
(–)Pt|Ag |Ag4RbI5| Ag3AuSe2, Ag2Se, Au |Pt(+)
с Ag4RbI5 в качестве Ag+ ион-проводящего твердого электролита в диапазоне температур 316–404 К в токе сухого Ar при атм. давлении. Полученная зависимость показана на рисунке.
Определите термодинамические параметры ΔG 2980, ΔS298 0 и ΔH2980 исследуемой реакции. Какое количество степеней свободы имеет система Au, Ag, Ag2Se, Ag3AuSe2? Какие фазы стабильны при Т = 298 K?
247. (6/Э-97). Константа диссоциации 2-тиофенкарбеновой кислоты (C4H3SCOOH) Ka = 3,3·
10–4 M при 25 °С.
а) Найти стандартный электродный потенциал Ео для полуреакции HA(aq) + ® A–(aq) + 1/2H2 (г).
б) Определить долю НА, продиссоциировавшей в 0,2 М водном растворе этой кислоты, содержащем также 0,1 М MgCl2.