6.1. Статистическое описание идеальных газофазных систем
Статсумма. Поступательная статсумма. Вращательная статсумма.
Внутреннее вращение. Колебательная статсумма. Энергия Гельмгольца. Энтропия. Внутренняя энергия, энтальпия, энергия Гиббса. Теплоемкость.
6.2. Определения равновесного состава газофазных систем в подходе статистической термодинамики
Химический потенциал. Константа равновесия KN. Выражения для константы равновесия КР.
6.3. Статистический расчет приближенных значений констант равновесия в реакциях изотопного обмена или изомеризации.
276. (1/3-95). На примере одноатомного газа, обладающего электронными и поступательными степенями свободы, показать, что его энтропия, найденная статистическим методом, действительно является экстенсивной функцией состояния.
277. (3/Э-96). Для молекулы HD известно, что Trot = 65 K. Оценить вращательную теплоемкость одной такой молекулы при T = Trot. Какова будет полная мольная теплоемкость газа из HD при указанной температуре?
278. (1/2-94). Атомы идеального одноатомного газа могут находиться в двух состояниях: на энергетическом уровне e
1 со статвесом 1 и на энергетическом уровне e
2 со статвесом 3. Найдите,
а) чему равна внутренняя энергия газа при Т®¥
и б) какая доля атомов находится на уровне с энергией e
2 при Т®
¥
.
279. (5/3-01). Найти мольную Ср для одноатомного газа при температуре 300 К в ситуации, когда молекулы газа имеют n электронно-возбужденных уровней, отстоящих от основного на одинаковом расстоянии e = 0,1 эВ. Рассмотреть ситуации n = 1; 2; 3.
280. (4/3-02). В газовой фазе при стандартных условиях согласно справочным данным энтропия
атома хлора Cl(г) равна
281. (2/3-05). Энтропия одноатомного газа Xe (MXe = 131,3 г/моль) при стандартных условиях равна S0Xe = 169,7 Дж/(моль К), а стандартное значение энтропии некоторого другого одноатомного газа – S0X = 126,1 Дж/(моль К). Какой это газ?
282. (2/Э-05). Найти зависимость электронной составляющей энтропии Sэл, внутренней энергии Uэл и теплоемкости Сv эл атома с двумя электронными уровнями от температуры, если факторы вырождения этих уровней равны 1, а характеристическая температура электронного возбуждения равна q . Оцените температуру, при которой электронная теплоемкость этого атома максимальна, если q = 1267 К.
283. (2/2-94). Зависимость теплоемкости кристалла простого вещества от температуры при низкой температуре описывается выражением
Cv = 1,26× 10–3T3 Дж/(г-атом× К)
Найдите термодинамическую вероятность состояния 1 г-атома этого кристалла при 20 К.
284. (5/Э-00). Зависимость теплоемкости кристаллического тела, составленного из одноатомных молекул, при низких температурах описывается уравнением
Сv = 1,26× 10–3 T3 Дж/моль× К.
Найти количество заполненных энергетических состояний, приходящихся на одну молекулу кристалл-образующего вещества при 20 К.
285. (5/3-00). Молекулы N2 и CO имеют очень близкие молекулярные постоянные, однако при этом обладают практически одинаковыми теплоемкостями и значительным различием в энтропии:
|
Сv(298 К), Дж/моль×К |
S0298, Дж/моль× К |
|
СО |
29,15 |
197,4 |
N2 |
29,10 |
191,5 |
Объяснить данные таблицы и найти аналитическое выражение для различия энтропии S0298 упомянутых молекул.
286. (1/3-98). Некоторое гипотетическое вещество состоит из неподвижных атомов, способных существовать только в одном из трех состояний с энергиями 0, e и e (два состояния имеют одинаковую энергию). Найдите статистическую сумму Q и теплоемкость Сv для 1 моля этого вещества через e , Т и универсальные постоянные. Постройте график зависимости Сv от Т для этого вещества.
287. (4/3-99). Каждая из N частиц идеального атомарного газа может находиться на одном из двух электронных энергетических уровней: e 1 со статвесом 1 и e 2 со статвесом 3. Какова внутренняя энергия и теплоемкость газа при Т ® ¥ ? Какая доля частиц газа имеет энергию e 1 при Т ® ¥ ?
288. (4/3-00). Молекула А2В характеризуется тремя частотами собственных колебаний 1013 с–1, 9× 1013 с–1 и 1014 с–1. Найти теплоемкость СV газообразного вещества А2В при температурах 100 и 1000 К. Найти значение СV при очень высокой температуре, полагая отсутствие электронных возбуждений и диссоциации молекул. Оценить температуру, значение которой начинает соответствовать понятию "очень высокой".
289. (2/3-95). Найти температурную зависимость константы равновесия физической адсорбции двухатомной молекулы на гладкой плоской поверхности.
290. (3/3-97). Оцените ожидаемую температурную зависимость энтальпии адсорбции бензола на металлическом никеле при температурах выше колебательной температуры молекул бензола.
291. (6/3-05). Запишите с точностью до множителя, как зависит давление водорода над поверхностью металлической меди от температуры и количества адсорбированного водорода, если известно, что адсорбция протекает по механизму Лэнгмюра и адсорбированный атом водорода на поверхности металла локализован? Количество центров адсорбции на поверхности Гs. Теплота адсорбции 80 кДж/моль. Можно полагать, что T << θкол H2.
292. (4/2-94). Найдите температурную зависимость константы равновесия реакции
CO2 = CO + O
в газовой фазе в диапазоне температур 1000–1500 К, если известно, что энергия связи С-О в молекуле СО2 равна 498,7 кДж/моль, длина этой связи равна 0,1167 нм и 0,1128 нм в СО2 и СО соответственно, а частоты колебаний в молекуле СО2 составляют v1 = 1351 см–1, v2 = 2396 см–1, v3 = v4 = 672 см–1, а в молекуле СО – v = 2170 см–1.
Электронные возбуждения частиц не учитывать.
293. (1/3-97).* Используя методы статистической термодинамики, найти температурную зависимость константы равновесия Кр для газофазной диссоциации двухатомной молекулы. Привести график ожидаемого изменения Кр в широкой области температур.
Решение294. (6/3-99). Как зависит от температуры константа равновесия для реакции окисления водорода кислородом в газовой фазе? Получить выражение для зависимости ln(Kp) от Т с точностью до постоянного слагаемого в приближениях θ rot << T << θ vib и θ vib << T << θ el. Корректны ли такие приближения? Считать энергии связи Do298(H–H) = 436 кДж/моль; Do298 (О–H) = 427,5 кДж/моль; Do298(О–О) = 498 кДж/моль.
295. (6/Э-07). Определите аналитический вид температурной зависимости константы равновесия реакции 3 А2 ↔ 2 А3. Известно, что трехатомная молекула A3 имеет нелинейное строение и вклады колебаний в статистические суммы А2 и А3 пренебрежимо малы.
296. (4/3-03). Определить равновесные концентрации орто- и пара-водорода при температурах 50, 100 и 300 К, если известно, что при превращении о-Н2 ® п-Н2 выделяется 1,418 кДж / моль теплоты.
297. (3/3-04) Найти зависимость эффективной мольной теплоёмкости
 298. (6/3-01). Оценить константу равновесия для реакции C2H6 = 2×
CH3 при 300 К и 1000 К, если известно, что для метильного радикала:
298. (6/3-01). Оценить константу равновесия для реакции C2H6 = 2×
CH3 при 300 К и 1000 К, если известно, что для метильного радикала:
Ix = Iy = 2,5.10–47 кг м2, Iz = 5.10–47кг м2; для этана: Ix = Iy = 40.10–47 кг м2, момент инерции вращения одной –СН3-группы этана относительно оси С–С связи 5.10–47 кг м2. Энергию связи С–С принять равной 300 кДж/моль. Считать, что при 1000 К внутреннее вращение в молекуле этана разморожено. Колебаниями пренебречь.
299. (5/3-02). Рассчитайте константу равновесия Кр реакции диссоциации закиси азота (N2O) на молекулярный азот и атомарный кислород при 1000 К. Энергия диссоциации N2O на N2 и О – 161,3 кДж/моль.
Форма |
Межъядерное расстояние, Å |
Частоты | |
N2O |
N=N–O, |
N=O 1,184 |
2224 |
N2 |
Линейная |
1,10 |
2358 |
300. (6/Э-02). В сосуде постоянного объема в газовой фазе в равновесии находятся изомеры А и В вещества с молекулярной массой М. Температура низкая, так что полные вращательные статсуммы для А и В соответственно равны
Колебательные степени свободы не возбуждены. Перепад энергии основных колебательных уровней для изомеров А и В равен D Ео. Общее число молекул в системе No. Определить кажущуюся теплоемкость системы.
301. (5/3-99). Для реакции H2 + D2
⇔2HD тепловой эффект реакции при абсолютном нуле температур
302. (2/Э-94). При каком давлении молекулярный водород может оказаться диссоциированным наполовину при температуре 500 °С? Известно, что энергия связи Н–Н в молекуле водорода составляет 435,9 кДж/моль, а длина этой связи – 0,741Å. Как изменится результат, если водород будет полностью дейтерированным? Энергию и длину связи в последнем случае считать прежними.
303. (2/3-96). Рассчитать стандартное абсолютное значение энтропии образования газообразного атома кислорода при 298,15 К, пренебрегая спин-орбитальным расщеплением основного уровня. В какую сторону и почему полученный результат будет отличаться от "точного" табличного значения.
304. (6/Э-95). Оценить степень диссоциации газообразной воды по реакции
H2O = H + OH,
при температуре 1000 °С и атмосферном давлении, если известно, что в молекуле воды длина связи О–Н равна 0,0957 нм, валентный угол Н–О–Н 104,5°, энергия ионизации 12,6 эВ, частоты колебаний молекулы ν 1 = 3652 см–1, ν 2 = 1595 см–1 и ν 3 = 3756 см–1. Для О–Н-радикала длина связи О–Н равна 0,097 нм, частота колебаний νО–Н = 3735 см–1, энергия ионизации 4,35 эВ. Возбуждением электронных степеней свободы пренебречь. Энергия разрыва связи О–Н в молекуле Н2О по реакции Н2О = ОН + Н равна 498,7 кДж/моль, а в радикале ОН по реакции ОН = О + Н – 427,8 кДж/моль.
305. (4/3-96). В термостате при стандартных условиях (суммарное давление в термостате 1 атм, температура 298 К) находится один моль идеального газа, способного к диссоциации по реакции
A = 2B.
Газ В тоже идеальный. Молекулярные статсуммы А и В связаны соотношением
ln(zA/
306. (3/3-98). Для реакции диссоциации молекулярного водорода
H2 = 2H
рассчитать константу равновесия KP при Т = 3000 К статистическим методом. rH-H = 0,7 А, θхар = 6300 К, энергия диссоциации Dоо = 350 кДж/моль. Электронным возбуждением пренебречь.
307. (4/3-98). В предварительно откачанный сосуд с 0,25 г силикагеля напустили 1 ммоль D2. Найти равновесный состав газовой фазы и концентрацию поверхностных гидроксильных групп после реакции изотопного обмена. При расчетах пренебречь изотопными эффектами, связанными с различием энергетических и массо-размерных характеристик молекул и молекулярных групп. Концентрация поверхностных ОН-групп на SiO2 8 мкмоль/м2 и не зависит от температуры и давления, удельная площадь поверхности силикагеля 500 м2/г.
308. (2/3-97). Используя методы статистической термодинамики, найти ожидаемое стандартное значение изменения энтропии, а также константу равновесия для реакции дейтерирования бензола
С6Н6 + D2 = С6Н5D + НD
в газовой фазе в области невысоких температур.
309. (5/3-08). Природное содержание изотопа 18О составляет 0,2 %. Известно, что мольная доля молекул озона O3 с молекулярной массой 50 составляет 6.10–3, а с молекулярной массой 52 – 1,2.10–5. Можно ли из этих данных сделать вывод о симметрии молекул озона?
310. (5/3-03). Оценить количество CD3H в системе после установления полного термодинамического равновесия, если исходно в систему ввели 1 моль СD4 и 2 моля Н2.
311. (5/Э-04).* Природное содержание изотопа 13С составляет 1,12 % всего углерода, а дейтерия 2Н – 1,6.10–4 всего водорода. Определить минимальную работу, необходимую для выделения 1 моля "сверхтяжелого" метана 13СD4 в изобарном процессе при 300 К, предполагается, что чистый метан доступен в неограниченных количествах.
Решение312. (6/Э-06). 2 моля равновесной смеси частично дейтерированного метана, содержащей атомы D и Н в соотношении 3:1, смешивают с 1 молем чистого метана СН4 при 298 К и давлении 1 атм. Определите изменение энтропии системы в этом процессе до установления полного равновесия, предполагая, что ΔH0298 реакций изотопного обмена равны нулю.
313. (4/Э1-94,99). Определите изменение энтропии, вызванное в одном моле HDO исчерпывающе полным дейтерообменом по реакции
HDO + D2 = D2O + HD.
314. (1/3-96). Найти изменение энтропии (после установления полного термодинамического равновесия) при смешении трех жидких компонентов: 1 моля Н2О, 1 моля D2О и 2 молей растворителя, не содержащего обменивающихся атомов водорода. Для простоты массы протия и дейтерия можно считать одинаковыми.
315. (3/Э-00). Образец изотопно-меченой воды приготовили добавлением 110 г D218O к 900 г Н216О. Определить число линейно независимых реакций изотопного обмена и рассчитать равновесный состав смеси, полагая энергетическую эквивалентность всех изотопомеров. Найти энтропию смешения при получении данной смеси.
316. (6/Э-01). Найти равновесный состав системы, первоначально содержавшей 8 молей CH3OH и 4 моля D2O. Считать, что в условиях нахождения системы протоны –CH3-группы не подвержены изотопному обмену. Влиянием изотопного состава на энергетические характеристики молекул и вращением молекул можно пренебречь. Как изменится результат при учете внутренних вращений в молекуле метанола?
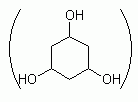
317. (5/3-05). Рассчитать равновесный состав в смеси дейтерозамещенного флюроглицина, если замещение H на D происходит только в ОН-группах, а мольные доли атомов H и D в смеси соответственно равны 0,3 и 0,7.
318. (3/3-01). К 1 молю нафталина, находящемуся в газовой фазе при давлении 10 Па и температуре 400 К, добавили 4 моля молекулярного дейтерия. Найдите, какое количество молекулярного протия будет находиться в газовой фазе после завершения реакции изотопного обмена при той же температуре, если различием в энергетике дейтерированных и обычных соединений, а также вкладом поступательных степеней свободы можно пренебречь.
319. (3/Э-98). Молярные доли стабильных изотопов 13С и 2Н в природных образцах углерода и водорода равны 1,12× 10–2 и 1,6× 10–4 соответственно. Определите минимальную работу по выделению 1 моля газообразного "сверхтяжелого метана" 13С(2Н)4 в изобарном процессе, приводимом при Т = 300 К. Исходным сырьем служит природный газ с содержанием метана 65 мол. %, доступный в неограниченных количествах.
320. (6/3-00). Система представляет собой сосуд с перегородкой, в одной половине которого находится 8,5 г NH3 при –50 °С, а в другой 10 г ND3 при той же температуре. Найти изменение энтропии системы при установлении полного равновесия после удаления перегородки. Считать, что смешение происходит изотермически.