Химический потенциал
Химическое равновесие. Химический потенциал. Зависимость химических потенциалов от давления и температуры для идеальных: газа, растворенного вещества, твердого тела.
Химическое равновесие в идеальных газах
Полезная работа химической реакции. Направление самопроизвольного химического процесса в изолированной и закрытой системах. Условия равновесия закрытой химической системы. Расчет величины химического потенциала. Химическое сродство реакции. Закон действующих масс. Константа равновесия. Уравнение изотермы, изобары и изохоры химической реакции (зависимость констант равновесия от давления и температуры). Направление протекания химических процессов при выводе системы из термодинамического равновесия. Принцип Ле-Шателье. Теплоемкость реагирующей смеси. Равновесие в системах с большим числом линейно-независимых реакций. Определение числа линейно-независимых реакций.
Химическое равновесие в неидеальных системах
Летучесть (фугитивность). Химический потенциал неидеального газа. Уравнения состояния реальных газов – уравнение Ван-дер-Ваальса, Соаве – Редлиха – Квонга. Химическое равновесие в реальных газах. Активность. Коэффициент активности.
46. (2/1-94). Вывести критерии самопроизвольного протекания термодинамических процессов в изолированной и закрытой системах.
47. (3/1-01). Вещество В способно диссоциировать согласно уравнению
Вгаз ↔ 2 Агаз.
В частности, при проведении процесса в режиме P = const достигается равновесная степень диссоциации αВ = 0,5,если вещество В вносится в реактор с начальным давлением ρоВ = 0,75 бар . Найдите степень диссоциации вещества В, если процесс проводится в режиме V = const , а в реактор вводится смесь аргона и газа В в мольном соотношении 1:1 при общем давлении 1 бар.
48. (3/1-03).Тепловой эффект реакции PCl5(г) = PCl3(г) + Cl2(г) в температурном интервале от 475 до 575 К равен 91546 Дж. При запуске PCl5 в пустой сосуд степень диссоциации этого соединения при 475 К и общем давлении 1,013 · 105 Па равна 0,428. Определить степень диссоциации PCl5 в этомсосуде при 575 К и общем давлении 2,026 · 105 Па.
49. (4/1-94). Для реакции N2(г) + 3 H2(г)= 2 NH3(г)
известно,что
Рассчитайте при 500 К величины Δ rGoT ,Δ rHoT,Δ rSoT , а также истинное молярное химическое сродство для этого процесса в условиях, когда парциальное давление N2 и H2 поддерживается равным 30 и 10 атм, а NH3 удаляется при парциальном давлении 3 атм. Экзергонна или эндергонна реакция в этих условиях?
50. (4/1-06). Сосуд,содержащий катализатор синтеза NH 3, был при 20° C заполнен смесью состава N2 : Н2 = 1:2 до атмосферного давления, а затем при постоянном объеме нагрет до 313 ° C.
Константа равновесия реакции N2 + 3 Н2
↔2NН3 зависит от температуры как:
Каким будет равновесное давление NН3?
51. (2/Э-04). В какой пропорции (по числу молей) необходимо смешать азот и водород, чтобы получить максимальный выход аммиака после установления равновесия при некоторых заданных температуре и давлении?
52. (4/1-97).* Для процесса диссоциации идеального газа А2 = 2А выразить в явном виде зависимость константы равновесия KP от степени диссоциации α, измеряемой в изобарном (а) и изохорном (б) процессах. При каком начальном давлении Po(A2) будет достигаться α = 0,5 в случаях (а) и (б), если KP = 1 бар?
Решение53. (2/Э-95). Оценить температуру, при которой может происходить заметная диссоциация воды по реакции
H2O = H2 + 1/2 O2,
если известны следующие термодинамические параметры:
для воды
Общее давление в системе считать близким к атмосферному.
54. (2/Э-98). При какой температуре следует проводить реакцию
SO2 + 1/2 O2 = SO3
для обеспечения количественного выхода триоксида серы при атмосферном давлении смеси? Известно, что:
|
|
|
|
|
tкип, |
|
|
SO 2 (г) |
–296,9 |
248,1 |
39,9 |
29,4 |
–10 |
55. (3/1-08). Константа реакции паровой конверсии СО (СО + Н2О →CO 2 + H2) при 673,3 K составляет 12,24, а при 652,2 K – 15,28. Оцените, при какой температуре должна подаваться в адиабатический аппарат смесь состава 12 % СО, 5% СО2, 38 % H2 ,45 % H2 , чтобы равновесное содержание СО в газе на выходе из реактора составляло менее 2 %. При оценке можно пренебречь изменением теплоемкости смеси в ходе реакции, Δr cP = 0 и полагать сP реакционной смеси равной 33 Дж/(моль К).
56. (3/Э-05). В процессе получения водорода влажный синтез-газ состава (54 % об. H2, 11 % CO, 6 % СО2 и 29 % H2 O) приводят в контакт с катализатором, при этом протекает реакция паровой конверсии СО:
СO + H2 O = CO2 + H2 .
Первую стадию паровой конверсии проводят до достижения равновесия при температуре 470оС, в результате чего содержание СО во влажном газе снижается до 5,0 % об. Оцените, при какой температуре следует проводить вторую стадию процесса для достижения остаточного содержания СО во влажном газе менее 0,5 % об. Для оценки полагать, что ΔrH0 = – 39 кДж/моль и слабо зависит от температуры.
57. (4/1-95). В промышленности большое значение играет реакция каталитической паровой конверсии метана в синтез-газ (смесь Н2 и СО):
СH4 + H2O ⇔ 3H2 + CO.
Используя данные термодинамического справочника, сделать приближенную оценку, при каких температурах следует проводить процесс для того, чтобы превращение метана происходило количественно. Требуется ли при этом дополнительно охлаждать или нагревать смесь в ходе процесса?
|
|
|
|
|
|
tкип, |
|
CH4 (г) |
–74,85 |
186,19 |
35,7 |
8,18 |
–161,5 |
58. (7/Э-01). В изобарический и поддерживающийся при давлении 2 бар теплоизолированный реактор, в котором может происходить реакция
CH4+ H2O ⇔ СО + 3Н2,
введены 1 моль метана и 10 молей воды. Нарисовать качественную зависимость теплоемкости данной системы от температуры и оценить среднюю теплоемкость системы в следующих диапазонах температур:
0–100 °С, 100–200 °С, 300–400 °С, 700–800 °С, 900–1000 °С.
При решении использовать таблицу из предыдущей задачи (4/1-95). Изменением теплоемкости газов при изменении температуры пренебречь.
59. (2/1-97) В термостатированном сосуде при постоянном давлении 3,62 · 106 Па находится равновесная смесь идеальных газов А и В. Константа равновесия А = В описывается уравнением
ln( KP) =–2500/ T + 5,0.
Определите теплоемкость cP одного моля этой равновесной смеси при Т = 500 К. При указанной температуре молярные теплоемкости ср(А) и ср(В) равны соответственно 22 и 38 Дж/(моль.К). В каком направлении будет меняться теплоемкость равновесной смеси при уменьшении общего давления?
60. (6/1-02).Оценить теплоемкость равновесной системы постоянного давления, содержащей 1 моль способного к изомеризации бутана, при температуре 550 К.
|
|
|
|
н-С4Н10 (г) |
–126,15 |
310,12 |
97,45 |
61. (3/1-05)Обратимая реакция A + B = C с участием идеальных газов описывается уравнением
Смесь, в которой каждый из газов содержится в количестве 3 моля, помещают в жесткий герметически закрываемый реактор объемом 66.48 л и нагревают в термостате при 800 K. Какое количество тепла будет передано термостатом реакционной системе в процессе достижения ею химического равновесия?
Считается, что реакция протекает с заметной скоростью лишь при температурах T ≥ 800 K.
62. (4/1-98). Оценить равновесный состав газовой фазы для реакции
2 ' C6H5 CH3 = м- C6H 4(CH3)2+ C6 H6
при 400 К и давлении 1 бар, если исходно в систему был введен только толуол.
| Вещество |
|
|
|
C6H5CH3( газ) |
50,00 |
320,66 |
63. (2/1-00). Стандартные энергии Гиббса образования изомерных углеводородов С4Н8 в стандартных условиях равны 120,58 кДж/моль для 1-бутена, 121,32 кДж/моль для 2-бутена и 110,42 кДж/моль для циклобутана. Принимая, что Δср = 0 для всех реакций изомеризации, и полагая, что тепловой эффект реакций не зависит от температуры, определите состав равновесной смеси указанных углеводородов при 400 °С.
64. (4/1-07). Определить состав системы после достижения парциального равновесия
реакции дегидратации этанола в бутанол-1
2 C2 H5OH → C4 H11 OH +
H2O, проводимой при постоянной температуре 100 °С, если исходно в реакторе присутствует только
этанол при давлении 1 атм.
|
|
|
|
|
|
этанол (г) |
–253,3 |
283 |
65 |
65. (2/Э-06). Оцените равновесное превращение этанола по реакции Гербэ при 600 К
2 C2H5 OH → C4H9OH + H2
в предположении отсутствия других химических превращений, если в качестве исходной смеси используют азеотроп вода-этанол, содержащий 95,6 масс. % спирта, а также известны следующие табличные величины:
|
|
|
|
|
|
Н2О (г) |
–241,82 |
188,84 |
CP≈ 33,19 + 0,009t (° C) |
66. (5/1-98). Для реакции N2O4 = 2 NO2 константа равновесия в газовой фазе составляет Кр= 1,36 бар при 55° С. Сколько молей N2O4 следует добавить в пустой сосуд объемом 10 л, чтобы концентрация NO2 при этой температуре стала равной 0,1 моль/л? Чему равен тепловой эффект реакции, если при 127 °С Кр = 51,9 бар.
67. (3/1-99).* Для реакции диссоциации Br2 (газ) =2 Br (газ) зависимость константы равновесия от температуры в единицах СИ имеет вид:
ln KP = –23009/ T + 0,663 lnT + 8,12
Оценить энергию связи в молекуле Br2.
Решение
68. (2/Э-08). При температуре 400 K получена равновесная газовая реакционная смесь A 2 и А, в которой оба вещества представлены в равных мольных количествах. Суммарное давление полученной смеси равно 2 бар. Определите энтальпию диссоциации А2, если известно, что после изохорного нагревания до температуры 500 K количество молей димера А2 в новой равновесной смеси уменьшилось в два раза.
69. (3/1-96). Основными компонентами атмосферы являются, как известно, О2 (21 %) и N2 (78 %). Оксиды азота N2O, NO и NO2 являются следовыми компонентами, и их фоновое содержание составляет соответственно 10–2, 10–3 и 10–3 ррm (ррm – миллионная доля). Находятся ли названные оксиды азота в термодинамическом равновесии с основными компонентами атмосферы и между собой? Ответ подтвердить расчетами.
|
|
|
|
|
tкип, |
|
|
О2 |
0 |
205,0 |
29,35 |
6,8 |
–183,0 |
70. (3/1-95). Константы равновесия двух одновременно протекающих газофазных реакций
А + B ⇔ и А + В ⇔ 2D
равны 1 и 4 соответственно. Найти максимально возможную полезную работу, которую способна совершить такая реакционная система, если в исходном состоянии в систему, поддерживаемую при постоянном общем давлении 2 бар, ввели по одному молю веществ А и В. Как изменится величина полезной работы, если увеличить давление в системе в 2 раза; разбавить реакционную смесь инертным газом в 2 раза?
71. (3/Э-02). Газообразный углеводород A участвует в двух реакциях, приводящих к получению изомеров В и С:
A ↔ B и A ↔ С.
Значения стандартных энергий Гиббса, энтальпий образования и теплоемкостей указанных веществ при 600 К приведены в таблице.
| Вещество |
ΔfGo(газ), |
ΔfНo(газ), |
ср(газ), |
| А |
–6,42 |
–186,12 |
165,98 |
| В |
–6,42 |
–154,39 |
157,84 |
| С |
–2,96 |
–184,57 |
179,19 |
Определите равновесный состав системы при 600 К. Какой из изомеров будет преобладать при последующем увеличении температуры? Почему?
72. (4/1-08).* Газообразный углеводород A участвует в двух реакциях, приводящих к получению изомеров В и С:
A ↔ B и A ↔ С.
Значения стандартных энтальпий, энтропий и потенциалов Гиббса образования указанных веществ при 1000 К приведены в таблице.
| Вещество |
ΔfНo(газ), |
ΔfGo(газ), |
So(газ), |
| А (Перилен) |
253,2 |
-734,7 |
987,9 |
Определите равновесный состав при 1000 К. Какой из изомеров будет преобладать при последующем повышении температуры?
Решение73. (6/1-99). Оценить равновесный состав газовой фазы после установления равновесия при температуре 900 К в сосуде объемом 150 л, в который ввели по 1 молю этана и пропана, способных к обратимому дегидрированию по реакциям
С2H6 = H2 + С2H4,
С3H8 = H2 + С3H6.
Из справочников известно, что
|
|
|
|
|
| С2H6 (г) |
–84,67 |
229,49 |
52,65 |
74. (4/1-01). При повышении температуры в присутствии некоторого катализатора пропан может превращаться по двум реакциям:
деметанирования C3H8= C2H4 + CH4
и дегидрирования C3H8 = C3H6 + H2.
Оценить равновесные составы смеси при давлении 2 бар и температурах 500, 800 и 1100 К, если исходно в реактор был введен только пропан при температуре реактора и давлении 2 бар. При какой температуре надо проводить процесс, чтобы получать преимущественно и количественно этилен, а не пропилен?
Известно, что:
|
|
|
|
|
tкип, |
|
| H2 (г) CH4 (г) C2H4 (г) C3H6 (г) C3H8 (г) C2H6 (г) |
0 –74,85 52,30 20,41 –103,85 –84,67 |
130,52 186,27 219,45 266,94 269,91 229,49 |
28,0 35,71 43,6 63,9 73,5 52,6 |
0,916 8,2 13,4 20,0 21,0 20,0 |
–252,9 –161,49 –103,8 –47,75 –42,07 –47,8 |
75. (4/1-02). В системе протекают две параллельные реакции:
С3Н8 = С2Н4 + СН4 ,
С3Н8 = С3Н6+ Н2.
Оценить равновесный состав системы при 600 К и общем давлении 1 бар, если в систему изначально был введен только пропан в количестве 1 моль. При решении использовать данные предыдущей задачи (4/1-01).
76. (5/1-03). Оценить равновесный состав газовой фазы для реакции
2 СН4 = С2Н6 + Н2
при 1100 К и давлении 1 бар, если в системе исходно был только метан в количестве 1 моль. При решении использовать данные предыдущих задач (4/1-01).
77. (2/1-00). Изопропиловый спирт в присутствии катализатора легко дегидратируется и дегидрируется по реакциям
CH3CHOHCH3 = CH3CHCH2+ H2O (I)
CH3CHOHCH3 = CH3COCH3+ H2 (II)
Оценить равновесный состав системы, исходно содержавшей изопропиловый спирт при давлении 1 бар, после установления в системе полного равновесия. Температура системы поддерживается при 100 °С. Известно, что:
|
|
|
|
|
tкип, |
|
| изопропанол (ж) |
–318,7 |
180 |
153,4 |
45,2 |
82,4 |
| пропилен (г) |
20,4 |
266,9 |
63,9 |
18,4 |
–47,8 |
| ацетон (ж) |
–247,7 |
200 |
125 |
29,7 |
56,2 |
| H2O (ж) Н2O (г) |
–285,8 –241,8 |
70,0 188,8 |
75,3 33,6 |
40,7 |
100,0 |
| H2 (г) |
0 |
130,5 |
28,8 |
0,916 |
–252,9 |
78. (5/1-06). Определить равновесный состав смеси изомеров ксилола при Т = 600 K, если исходно в жесткий реакционный сосуд объемом 20 л было внесено 2 моля жидкого м-ксилола при давлении инертного газа внутри реактора 1 атм и температуре 298 К. После загрузки реагента сосуд был закупорен и нагрет до нужной температуры. Известно, что после нагревания вся жидкость испарилась. Газовую смесь считать идеальной, а теплоемкости не зависящими от температуры. При какой температуре содержание в смеси о-ксилола будет превышать содержание п-ксилола?
|
|
|
|
|
tкип, |
|
| о-ксилол(г.) м-ксилол(г.) м-ксилол(ж.) п-ксилол(г.) |
19,00 17,24 –25,42 17,95 |
352,75 357,69 252,17 352,42 |
122,09 118,86 183,26 121,14 |
36,24 35,66 35,66 35,67 |
144 139 139 138 |
79. (5/1-00). Получению муравьиной кислоты в газовой фазе нередко препятствует ее термодинамическая нестабильность вследствие возможности распада по реакциям
НСООН = Н2 + СО2,
НСООН = Н2О + СО.
Оцените, при какой температуре следует получать это соединение в газовой фазе с общим давлением около 1 бар, чтобы доля равновесного распада НСООН по указанным реакциям не превышала 10 %. Какие основные побочные продукты будут присутствовать при этом в реакционной смеси? Известно, что:
|
|
|
|
|
tкип, |
|
| НСООН (ж) СО (г) Н2 (г) СО2 (г) Н2О (ж) Н2О (г) |
–409,19 –110,52 0 –393,51 –285,83 –241,82 |
128,95 197,54 130,52 213,68 70,08 188,72 |
99 29 28 37 75 34 |
22,24 6,040 0,916 25,23 40,66 40,66 |
100,7 –191,5 –153,8 –78,50 100,0 100,0 |
80. (5/1-07). Реальный газ подчиняется уравнению состояния
PV = RT[1+
81. (5/1-08). Оцените коэффициент летучести для метанола при давлении
30 атм, T = 500 K.
P = RT/(V–b) – a/V2.
a = 0,965 м6 Па/моль2; b = 6,7 10–5 м3
/моль.
Молярный объем газа при указанных условиях составляет 1,2 л.
82. (6/1-05). В смеси двух газов А и В, находящейся при постоянном давлении, возможно протекание реакции А ↔В с константой равновесия Кр. Газ А подчиняется закону идеальных газов. Для газа В справедливо уравнение состояния P = RT/(V–b), где b – константа. Определите коэффициент летучести для газа В. Зависит ли равновеcный состав от давления в системе?
83. (6/1-04). Оценить равновесный состав газовой фазы для реакции синтеза метанола
СО + 2Н2 = СН3ОН
при t = 250 ° С,P = 100 атм и исходном соотношении компонентов H2:CO = 2. Величину ΔrCPсчитать равной –25 Дж/моль· K. Коэффициенты летучести компонентов в условиях проведения процесса полагать равными γСО = γН2 = 1,04; γCH3OH = 0,55.
| Вещество |
|
|
| CO Н2 CH3ОН |
–110,5 0 –201 |
197,55 130,52 239,76 |
84. (1/Э-08) Рассчитайте равновесное парциальное давление аммиака, если его синтез проводят из азота и водорода при H2:N2= 3 при постоянном давлении 160 атм и температуре 700 K. Зависимостью теплоемкости от температуры можно пренебречь. При расчете учтите, что коэффициенты летучести аммиака, водорода и азота для равновесного состава смеси в условиях реакции составляют соответственно 0,93, 0,95 и 0,96.
|
|
ΔH°f,298 |
So298, |
Ср 298, |
| N2 |
0 |
191,6 |
28,9 |
| H2 |
0 |
130,7 |
28,8 |
| NH3 |
–45,9 |
192,8 |
35,7 |
85. (3/1-94). В закрытый, предварительно вакуумированный сосуд поместили некоторое количество твердого NH4Cl, способного к обратимому разложению по реакции
NH4Cl(тв.) ↔ NH3(г)+ HCl(г).
После установления термодинамического равновесия в сосуде оказалось, что давление газа внутри него стало равным 2 атм.
Оцените температуру сосуда и изобразите качественно график P = P(Т) для дальнейшего нагревания сосуда.
| Вещество |
NH4Cl(тв) |
NH3(г) |
HCl(г) |
| ΔfHo298(кДж/моль) |
–314 |
–46 |
–92 |
| ΔSo298 (Дж/моль·К) |
96 |
193 |
187 |
86. (3/1-97). Рассчитать стандартную энтальпию образования,
QP
= –189 кДж/моль его разложения при стандартных условиях по реакции
NH4Cl O4(крист) = 0,5N2(газ) + 0,5Cl2(газ) + О2(газ) + 2Н2О(газ).
|
|
|
|
|
| Cl2(газ) |
0 |
233 |
34 |
| H2(газ) |
0 |
131 |
29 |
| H2O(газ) |
–242 |
189 |
34 |
| N2(газ) |
0 |
192 |
29 |
| NH3(газ) |
–46 |
193 |
35 |
| O2(газ) |
0 |
205 |
29 |
87. (4/Э-95). В два предварительно откачанных и помещенных в термостат сосуда, соединенных между собой трубкой, поместили раздельно СаСО3 и СаО. Что будет находиться в сосудах после установления термодинамического равновесия при температуре, достаточной для разложения карбоната? Как изменится результат, если: а) в обоих сосудах исходно находится чистый CaCO3; б) в сосуды исходно добавлен СО2? Соединения кальция можно считать нелетучими.
88. (5/Э1-94,99). Термическое разложение карбонатов двух различных металлов
MCO3= MO + CO2
описывается уравнениями
lg KP1 = –9000/T + 2,0, (1)
lg KP2 =–3000/T + 3,0. (2)
В вакуумированный и термостатированный при 1000 К сосуд объемом 10 л вносится по 0,01 моля каждого карбоната. Определите состав системы после ее прихода в равновесие. Как изменится ответ, если исходно сосуд не был вакуумирован?
89. (5/1-04) В вакуумированный сосуд объемом 22,4 л поместили по 0,1 моля CaCO3 и BaCO3 и нагрели до 1000 К. Определить равновесный состав системы, если известна температурная зависимость констант равновесия Кр в интервале 900 – 1000 К для процессов:
СаСО3(тв) = СаО(тв) + СО2(г); ln KP = – 20489/>T + 17,74;
ВаСО3(тв)= ВаО(тв) + СО2(г); ln KP = – 34381/T + 23,15.
90. (5/1-97). В вакуумированный сосуд объемом 32,8 л поместили по 1 молю CaO и PbCO3 и нагрели до 800 К. Найти равновесный состав (PCO2, атм и количества твердых компонентов, моль), если известна температурная зависимость констант равновесия K P для процессов:
(1) CaCO3(тв) = CaO(тв) + CO2(газ); lgK1 = –8000/T + 10,0;
(2) PbCO3(тв) = PbO(тв) + CO2(газ); lgK2 = –6000/T + 8,0.
Как изменится равновесный состав системы, если вместо CaO взять 1 моль CaCO3, а вместо PbCO3 – 1 моль PbO?
Оценить, при каких температурах возможна твердофазная реакция
CaCO3 + PbO = CaO + PbCO3,
если известно, что указанные оксиды и карбонаты не образуют твердых растворов.
91. (4/1-03). В исходно вакуумированный герметичный термостатированный сосуд с поршнем, под которым поддерживается постоянное давление 1 атм, поместили по 1 молю твердых веществ А и С, способных к разложению по реакциям:
А(тв)=B(газ) +A’(тв); KP1=1 бар;
C(тв)= D(газ)+C’(тв); KP2=3 бар.
Известно, что вещества В и D способны реагировать в газовой фазе по реакции
В + D = Е KP3 = 3 бар–1.
Определить состав (в молях) равновесной газовой смеси под поршнем. Как изменится ответ, если в сосуде под поршнем исходно находился также инертный газ под давлением 1атм?
92. (4/1-00). В химических циклах переработки плутония используется перевод этого элемента в газообразное соединение по реакции с молекулярным фтором при 300° C:
PuF4(тв) + F2(г) = PuF<6(г).
Каков равновесный состав (мол. %) газа после прохождения такой реакции, если общее давление газа 1 бар, а значение Кр = 26,6 ·10–4? Сколько молей F2 необходимо ввести в реактор для получения 1 г PuF6 в этих условиях? Атомная масса Pu – 244, F – 19.
93. (6/1-00). В адиабатической оболочке при 980 К и давлении 1 бар находится 1 моль кристаллического вещества А, для которого в определенных условиях возможно превращение в кристаллическое вещество В. Стандартные энергии Гиббса этих веществ, не способных к образованию твердых растворов, описываются уравнениями
GA = 81000 – 25T – 25TlnT,
GB = 80000 – 24T – 25TlnT.
Опишите равновесное состояние системы (температуру и равновесный состав).
94. (3/1-02). Стандартная энергия реакции дегидратации соли MX2H2(тв) = MX2(тв) + H2O(газ) описывается уравнением
Δ DrGo= 36170,7 – 68,514 T, Дж/моль.
В первый реакционный сосуд помещают 1 моль моногидрата и 1 моль безводной соли, во второй – 1,2 моля безводной соли. Сосуды соединяют трубкой и нагревают: первый – до температуры 500 К, второй – до температуры 490 К. Кроме того, обе формы соли во втором сосуде механически сжимают до давления 500 бар. Общий объем газовой фазы, не занятой реагентами, равен 0,12 л. Мольные объемы безводной формы соли и моногидрата равны 40,02 см3 и 56,89 см3 соответственно. Опишите конечное состояние системы.
95. (6/1-01). Кристаллогидраты (M1)SO4· 6 H2O и (M2)SO46· H2O способны к дегидратации:
(M1)SO4· 6 H2O = (M1)SO4· 4 H2O + 2 H2Oгаз (1)
(M1)SO4· 6 H2O = (M1)SO4· 5 H2O + H2Oгаз (2)
где М1 и М2 – двухвалентные металлы. Константы равновесий (1) и (2) в области температур 400 – 600 К описываются уравнениями:
KP1 = 156,00 – 77980/Т, бар2,
KP2 = 191,00 – 95450/Т, бар.
В сосуд объемом 8 л при Т = 500 К поместили оба кристаллогидрата в равных количествах 0,01 моля. Опишите равновесное состояние.
96. (4/2-00).* Для систем
CuSO4·5H2O = CuSO4·3H2O + 2H2O,
CuSO4·3H2O = CuSO4· H2O + 2H2O,
CuSO4·H>2 = CuSO4 + H2O
давление насыщенного пара при 50° С равно соответственно 47, 30 и 4,4 торр. В герметичный сосуд небольшого объема поместили 1 моль безводного сульфата меди, откачали и затем стали вводить пары воды при данной температуре. Нарисовать зависимость давления паров воды в системе от количества введенных молей воды. Пояснить приведенный рисунок.
97. (2/Э-97). Оценить степень диссоциации метана в реакции
CH4 = C+ 2H2
при общем давлении 1 атм и температурах 300, 600, 900 и 1200 К, если известны следующие термодинамические параметры:
|
|
|
ρ, |
Ср 298, |
|
|
СН4 (г) С (графит) С (алмаз) Н2 (г) |
– 74,85 0 –1,828 0 |
186,19 5,74 2,368 130,52 |
2,265 3,515
|
35,7 8,5
24,6 |
98. (1/Э-07). В проточный реактор подают метан со скоростью 360 моль/час, в реакторе протекает реакция разложения метана до графита и водорода при давлении 1 атм. Обогрев потока метана и реактора осуществляют при помощи хорошо термоизолированной электропечи. Какую мощность нагрева необходимо поддерживать, чтобы на выходе газ содержал более 90 % H2 ? При оценке используйте данные предыдущей задачи (2/Э-97) и полагайте, что реакция разложения метана протекает до равновесия, а теплоемкости веществ не зависят от температуры.
99. (3/Э-97). Основываясь на данных предыдущей задачи (2/Э-97 и 1/Э-07), вывести уравнение Р-Т кривой сосуществования графита и алмаза. При каких условиях алмаз можно получать прямо из метана?
100. (2/1-95). Константы равновесия последовательной термической дегидратации кристаллогидрата MSO4·2H2O (M - металл)
4·2H2O (тв) ⇔ MSO4·H2O ( тв) + Н2О (г), (1)
4·H2O (тв) ⇔ MSO4 (тв) + Н2О (г), (2)
описываются уравнениями
lgKP1 = 11,0 – 12 ·103/Т,
lg KP2 = 14,0 – 15·103/Т.
Возможно ли достичь состояния, в котором равновесно сосуществуют все три формы соли, если в начале процесса в сухую герметически закупориваемую колбу объемом 10 л вносится 0,005 моля соли в виде дигидрата?
101. (6/1-98). Карбонат кальция в природе существует в двух кристаллических модификациях – кальцит и арагонит. Найдите уравнение кривой сосуществования обеих модификаций, если из справочников известно, что
|
|
|
|
|
| Кальцит арагонит СаО СО2 |
–1206,8 –1207,0 –635,1 –393,5 |
91,7 88,0 38,1 213,7 |
82 82 42 37 |
Какая из этих модификаций наиболее устойчива при Т = 300 К, р = 1 бар? Устойчив ли карбонат кальция к разложению в этих условиях на СаО и СО2, если он находится в сухом воздухе с содержанием СО2 0,5 об. %? При какой температуре он начнет разлагаться при сохранении давления воздуха на уровне 1 бар? Молекулярная масса карбоната кальция равна 100,1.
102. (6/Э-94). Превращение кристаллической модификации углекислого кальция “арагонит” в модификацию “кальцит” при 25 °С сопровождается уменьшением изобарно-изотермического потенциала на 190 кал/моль. При каком давлении при этой же температуре обе формы CaCO3 могут сосуществовать? Известно, что плотность арагонита 2,93 г/см3, а кальцита – 2,71 г/см3.
103. (5/1-99). Определите направление реакции
| ΔD fHо298, |
Sо298, |
сPо298, |
ρ298, |
M, г |
|
| Fe2O3 Fe H2 H2O (г) |
–882,16 0 0 –241,83 |
87,45 27,15 130,52 188,84 |
103,76 24,98 28,83 33,61 |
5,25 7,874 — — |
159,69 55,85 2 18 |
104. (6/1-06). Система состоит из двух замкнутых резервуаров, соединенных небольшой трубкой. Систему вакуумировали, в резервуар (1) поместили 1 моль Na2CO3 и нагрели до 400 K, а в резервуар (2) – 2 моля CaCO3. Парциальное давление паров воды поддерживается равным 1 бар. Объем, не занятый твердыми веществами, в каждом из резервуаров составляет 5 л. Оценить, при какой минимальной температуре резервуара (2) возможно получение питьевой соды.
CaCO3 = CaO + CO2 ΔrGo(T) = – 154,6T + 175800 Дж/моль
2NaHCO3 = Na2CO3 + H2O + CO2 ΔrGo(T) = – 345,4T + 132200 Дж/моль
Ca(OH)2 = CaO + H2O ΔrGo(T) = – 128,4T + 101500 Дж/моль
105. (5/1-05). Известно, что при прокалке на воздухе при высоких температурах оксид кобальта Сo3O4 восстанавливается до СоО. Оценить температуру протекания этого процесса на воздухе, если известны следующие величины, при оценке не учитывать зависимость теплоемкости от температуры.
Вещество |
|
|
|
Оксид кобальта Со3O4 Оксид кобальта СоО Кислород О2 |
–910,0 –237,8 0 |
114,4 52,83 205,0 |
123,1 55,0 28,9 |
106. (3/1-07). Для окисления окиси углерода при 600 оС в реактор загрузили 0,6 моля магнетита Fe3O4, 1,5 моля СО и 0,5 моля СО2. Процесс
Fe3O4 + CO = 3 FeO + CO2,
проведенный при постоянном давлении 5.104
Па, завершился получением равновесного газового раствора, средний молекулярный вес которого оказался равным 36,56. Определите константу равновесия и количество оставшегося магнетита.
107. (2/1-07).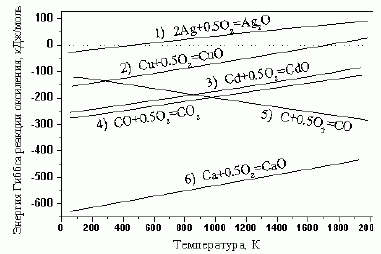 *
Зависимости
*
Зависимости
Определите:
1) при какой T и какие металлы могут самопроизвольно восста-навливаться из соответ-ствующих оксидов;
2) при какой T и какие металлы можно восста-новить монооксидом углерода;
3) при какой T и какие металлы можно восстано-вить графитом? Парциальные давления всех газообразных веществ считать равными 1 атм.
108. (6/1-07). 50 тыс. лет назад на месте современной Аризонской пустыни упал метеорит весом 300 тыс. тонн, а в 1962 году в образовавшемся кратере обнаружили ранее не известную форму SiO2. Используя данные таблицы, предположите, какую кристаллическую фазу SiO2 нашли в кратере, если при столкновении метеорита с Землей давление достигало 1,6·105 атм, а температура – 1300 ºС; МSiO2 = 60 г/моль.
| Модификация SiO2 |
Плотность, |
|
|
|
α-кварц |
2,655 |
–910,7 |
41,5 |
44,6 |
Тридимит |
2,30 |
–905,2 |
41,84 |
44,43 |
Кристобаллит |
2,33 |
–908,0 |
42,6 |
44,56 |
Коэсит |
3,01 |
–905,9 |
40,4 |
45,39 |
Стишовит |
4,35 | –861,5 |
27,8 |
42,97 |
109. (6/1-08). Раздельное окисление СО водяным паром проводят следующим образом. В сосуд, содержащий 2 моля Н2О при 1 атм, помещают порошок металлического Ni массой 0,01 г, дожидаются окончания всех химических превращений. Затем порошок извлекают из 1-го сосуда и помещают во второй сосуд, содержащий 1 моль СО при 1 атм, и также дожидаются окончания всех химических превращений. После чего процедуру повторяют, т. е. порошок периодически приводят в контакт с реагентами в первом и во втором сосудах, в которых поддерживают постоянную температуру 600 К. Найти состав смесей в обоих сосудах после 50-ти повторных циклов. Известны константы равновесия реакций при Т = 600 К:
MNi = 58,69 г/моль