Энергоустановка на основе высокотемпературных полимерных топливных элементов
В Институте катализа создана энергоустановка на базе батареи ВТ ПОМТЭ (Фирма ZBT, Дуйсбург, Германия). Батарея состоит из 12 моноячеек (50 см2 каждая). В качестве топлива используется синтез-газ, получаемый паровой конверсией метанола. Установленный реактор паровой конверсии метанола может обеспечить работу батареи мощностью 500 Вт. Энергоустановка работает в автономном режиме, потребляя 30 Вт на собственные нужды (воздушные компрессоры, вентиляторы, электронная система управления). На выставке “Hydrogen + Fuel Cell” в Ганновере (Германия) в апреле 2007 г. установка проработала на номинальной мощности в течение 5 дней.

Аннотация
В настоящее время большой интерес проявляется к разработкам высокотемпературных полимерных топливных элементов на основе термостойкого полимера типа полибензимидазола и фосфорной кислоты, используемой в качестве электролита. Эти топливные элементы свободны от указанных выше недостатков. Они работают при температурах 140-180°С, концентрациях СО до 5% и не требуют увлажнения подаваемого в ячейку газа, а достигнутый на сегодня ресурс работы составляет 18000 ч. Такая низкая чувствительность ВТ ПОМТЭ к концентрации оксида углерода значительно упрощает схемы получения водородсодержащего газа, подаваемого в батарею, поскольку не требует доведения концентрации СО до уровня 10 ppm.
В Институте катализа создана энергоустановка на базе батареи ВТ ПОМТЭ (Фирма ZBT, Дуйсбург, Германия). Батарея состоит из 12 моноячеек (50 см2 каждая). В качестве топлива используется синтез-газ, получаемый паровой конверсией метанола. Реактор, в который подается водометанольная смесь, разогревается до рабочей температуры за счет сжигания паров метанола в каталитической горелке. Получаемый синтез-газ после конденсации паров воды при комнатной температуре подается непосредственно в анодное пространство батареи без дополнительной очистки от СО, концентрация которого составляла 1-2 об.%. Катоды батареи обдуваются воздухом со скоростью 10 л/мин. После выхода батареи на рабочий режим отходящий анодный газ с остатками водорода подается на горелку, что снижает расход метанола, необходимого для поддержания рабочей температуры реактора. Номинальная электрическая мощность батареи – 160 Вт. Максимальная электрическая мощность, снимаемая с батареи составила 170 Вт при токе 28 А и напряжении 6,1 В.
Селективное метанирование CO на 10 вес.%Ni/CeO2
В Институте катализа разработаны новые высокоактивные непирофорные никель-цериевые катализаторы для альтернативного способа очистки водородсодержащего газа от примеси СО – селективного метанирования. В сравнении с очисткой путем селективного окисления СО, процесс селективного метанирования значительно проще, так как не требует введения в реакционную смесь кислорода (воздуха). Кроме того, при этом не происходит разбавления водородсодержащего газа азотом, а при использовании достаточно активных катализаторов возможно проводить очистку водородсодержащего газа до уровня СО ниже 10 ppm в широком температурном интервале.
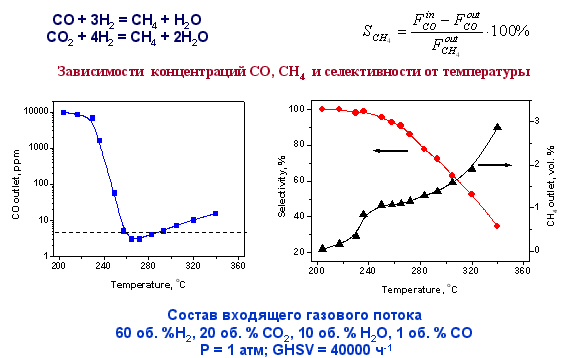
Аннотация
Для того чтобы водородсодержащую смесь подавать в низкотемпературные топливные элементы с протонообменной мембраной (ПОМТЭ) необходимо провести глубокую очистку газа от СО. В последние годы во всем мире проводились исследования по разработке катализаторов и процессов, позволяющих эффективно удалять СО из водородсодержащих смесей. Основное внимание уделялось изучению реакции селективного окисления СО. С другой стороны, реакция селективного метанирования СО в присутствии СО2 также может являться одним из возможных способов очистки водородсодержащих смесей от оксида углерода. В Институте катализа предложены новые высокоактивные непирофорные никель-цериевые катализаторы для этой реакции. В сравнении с очисткой путем селективного окисления СО, процесс селективного метанирования значительно проще, так как не требует введения в реакционную смесь кислорода (воздуха). Кроме того, при этом не происходит разбавления водородсодержащего газа азотом, а при использовании достаточно активных катализаторов возможно проводить очистку водородсодержащего газа до уровня СО ниже 10 ppm в широком температурном интервале.
Разработка и испытания поглотителя СО2 для адсорбционно-каталитической конверсии углеводородов
Разработан поглотитель СО2 с динамической емкостью 12 вес.%, стабильной на протяжении нескольких тысяч циклов «карбонизация-разложение». Данный материал может быть использован в процессе адсорбционно-каталитической конверсии углеводородов для одностадийного получения водорода с низким содержанием СО.
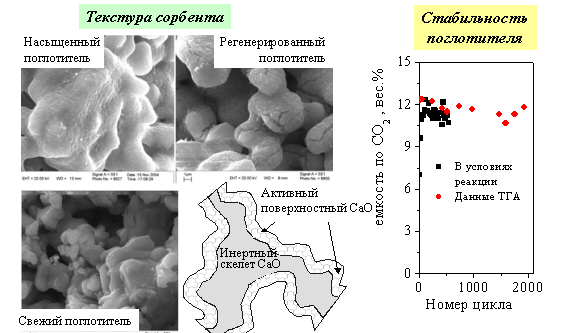
Аннотация
На основании проведенного исследования предложена оптимальная текстура поглотителя, обладающая одновременно высокой динамической емкостью и прочностью, достаточной для эксплуатации в реакторе с неподвижным слоем. Объем пор оптимального СаО должен составлять около 0,3-0,5 см3/г при размере первичных частиц 2-4 мкм. Разработана процедура синтеза данного материала методом термического разложения при 1300°С порошков карбоната кальция с размером частиц не более 5 мкм.
Проведенные ресурсные испытания поглотителей СаО с различной пористой структурой показали, что, в зависимости от начальной текстуры, динамическая емкость поглотителей может достигать более 40 вес.%, однако такие материалы обладают низкой прочностью и недостаточной стабильностью. Материал с оптимальной текстурой продемонстрировал стабильную динамическую емкость 12 вес.% на протяжении 2000 циклов в термогравиметрических тестах. В проточном адсорбционно-каталитическом реакторе в условиях паровой конверсии этилового спирта динамическая емкость данного материала также составляла 12 вес.% на протяжении более 400 циклов. С помощью данного материала удалось в одну стадию провести паровую конверсию метилового спирта в водород с содержанием СО и СО2 менее 100 ппм.
Ответственный исполнитель: А.Г.Окунев
Создание нового поколения постметаллоценовых каталитических систем
Синтезированы 23 фенокси-иминных комплекса титана на основе лигандов, содержащих в иминной группе циклогексил, фенил, адамантил, тритил, изоборнил, пентафторфенил и различные заместители в фенокси-группе (трет-бутил, кумил, изоборнил, 1-фенилэтил и др.) и изучена их каталитическая активность при полимеризации этилена. На основе сопоставительного анализа результатов изучения активности полученных комплексов с сокатализатором метилалюмоксаном выявлены особенности влияния заместителей у иминного азота и в фенокси-группе. Определены оптимальные условия нанесения фенокси-иминного катализатора с R1 = фенил5, R2 = R3 = tBu, R4=H, на MgCl2/RnAl(OEH)3-n (R= (C2H5)3, OEH=2-этил-1-гексоил). Полученный нанесенный катализатор обеспечивает протекание полимеризации со скоростью в 2.7 раза выше по сравнению с процессом, проводимым в режиме in situ. Помимо уникальных каталитических свойств, полученные нанесенные каталитические системы имеют высокий потенциал в отношении регулирования морфологии полимера.
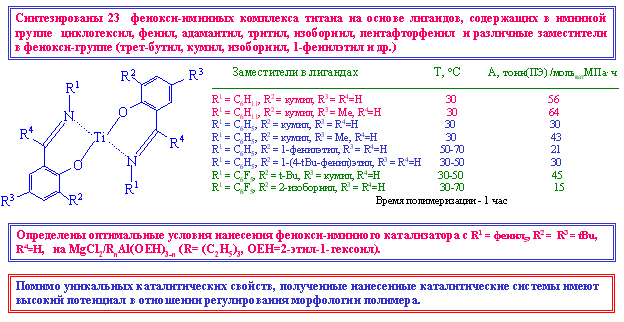
Аннотация
При взаимодействии салициловых альдегидов, содержащих в положении-3 различные заместители (трет-бутил, кумил, 1-фенилэтил и др.) с циклогексиламином, анилином и перфторанилинами получена новая группа фенокси-иминных лигандов и 23 комплекса титана (IV) на их основе. Изучено кинетическое поведение при полимеризации этилена бис(фенокси-иминных) комплексов титана c различным строением лигандов при использованием сокатализатора метилалюмоксана (МАО).
Сверхвысокая ММ образцов полиэтилена, полученных в присутствии комплексов с фторсодержащими заместителями в фенильном кольце иминного азота и различными заместителями в фенокси-группе, и ее увеличение с течением времени полимеризации свидетельствуют о протекании полимеризации по “живому” механизму, при этом фтор в активном центре при полимеризации этилена взаимодействует с b-водородом полимерной цепи, предотвращая b-гидридный перенос, особенно в начальном периоде реакции.
Сопоставление активности комплексов всех трех групп указывает на то, что изменение строения заместителей у иминного азота и заместителей в фенокси-группе зависимо и сопряженно влияют на активность комплексов при полимеризации.
Полиэтилены, получаемые на фенокси-иминном комплексе бис[(3,5-дитретбутил-салицилиден)анилинато]TiCl2, постадийно нанесенном в оптимальных условиях на MgCl2/RnAl(OEH)3-n (R= (C2H5)3, OEH=2-этил-1-гексоил), по активности в 2.7 раза превышают активность, достигаемую при проведении процесса полимеризации в режиме in situ.
Координаторы:
акад. Г.А.Толстиков
член-корр. РАН С.С.Иванчев
Влияние ионных жидкостей на направление реакции окисления этилена нитратом лития в присутствии комплексов Pd(II)
Реакцию окисления этилена нитратом лития в присутствии комплексов Pd(II) исследовали в присутствии ионных жидкостей EMImOAc, EMImBF4 и EMImBr. Добавки 1-этил-2метилимидазолий бромида служили одновременно как компонент растворителя и как реагент. В присутствии EMImBr этилен превращался в дибромэтан. Реакция окисления этилена замедлялась по мере увеличения содержания воды в среде 3-компонентного растворителя HOAc-EMImBr-H2O, хотя даже в чистой воде не наблюдалось выпадения металлического палладия, и основным продуктом превращения этилена оставался дибромэтан.
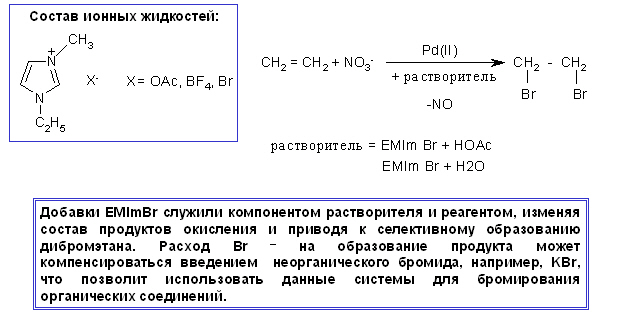
Аннотация
Основным продуктом окисления этилена в системе Pd(OAc)2-LiNO3 в среде уксусной кислоты является моноацетат этиленгликоля. В работе изучалось влияние органических солей EMImOAc, EMImBF4 и EMImBr на ход реакции окисления в среде уксусной кислоты и смесей кислоты с водой. Было обнаружено, что в присутствии бромида окисление этилена протекало с достаточно высокой скоростью, тогда как две другие соли дезактивировали катализатор.
Добавки EMImBr служили одновременно как компонент растворителя и как реагент. В присутствии EMImBr этилен превращался в дибромэтан. Реакция окисления этилена замедлялась по мере увеличения содержания воды в среде 3-компонентного растворителя HOAc-EMImBr-H2O, хотя даже в чистой воде не наблюдалось выпадения металлического палладия, и основным продуктом превращения этилена оставался дибромэтан.
Анализ спектров поглощения реакционных растворов показал, что до контакта с этиленом в присутствии EMImBr палладий находится в виде бромидных комплексов. Изменения спектров, происходящие во время реакции с этиленом, могут быть объяснены вначале вхождением этилена в состав комплекса Pd(II), а затем образованием нитрокомплекса палладия. Предполагается, что координированная на Pd(II) нитрогруппа окисляет Br- до Br2, окислительное присоединение которого к этилену дает дибромэтан.
Введение неорганического бромида, например, KBr, который хорошо растворятся в уксусной кислоте в присутствии EMImBr и может компенсировать расход анионов на образование продукта, позволит использовать данные системы для бромирования органических соединений.
Т.А.Баландина, Т.В.Ларина, Н.Ю.Адонин, Н.И.Кузнецова
Новая реакция окисления воды
Открыта новая реакция окисления воды радикалами кислорода О–. Реакция протекает при 5–200°С по механизму отрыва водорода, приводя к образованию поверхностных гидроксильных групп и выделению O2 в газовую фазу. Выделение O2 из воды подтверждается рядом убедительных экспериментов, включая применение изотопов кислорода. Помимо каталитического и фотокаталитического окисления, реакция O– с водой может играть определенную роль и при протекании некоторых биологических процессов, например, процесса фотосинтеза, в ходе которого также происходит выделение O2 из воды в газовую фазу.
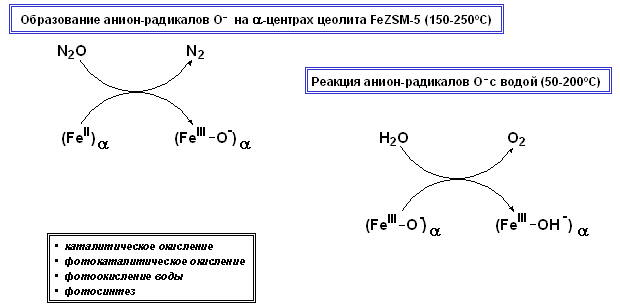
Аннотация
Анион-радикалы кислорода O– привлекают большое внимание исследователей как активные интермедиаты в реакциях каталитического и фотокаталитического окисления. В этой связи особый интерес вызывают цеолиты FeZSM-5, на которых концентрация О– может на 2-3 порядка превышать их концентрацию на традиционных оксидных системах. Как показано в предыдущих работах Института, образование O– происходит на особых комплексах двухвалентного железа, так называемых альфа-центрах, при их окислении закисью азота (“веселящим газом”):
(FeII)a + N2O ® (FeIII–O–)a + N2 (1)
Исследование этой модельной системы позволило открыть ранее неизвестную реакцию, а именно, реакцию окисления H2O радикалами кислорода О–:
2 (FeIII–O–)a + H2O ® 2 (FeIII–O–) + ½ O2 (2)
Реакция протекает при 5–200°С по механизму отрыва водорода, приводя к образованию поверхностных гидроксильных групп и выделению O2 в газовую фазу. Выделение O2 из воды подтверждается рядом убедительных экспериментов, включая применение изотопов кислорода.
Помимо каталитического и фотокаталитического окисления, реакция O– с водой может играть определенную роль и при протекании некоторых биологических процессов, например, процесса фотосинтеза, в ходе которого также происходит выделение O2 из воды в газовую фазу.
Г.И. Панов, Е.В. Староконь, Л.В. Пирютко, Е.А. Паукштис, В.Н. Пармон