
Тел.: +7 (383) 330-67-71, факс: +7 (383) 330-80-56, E-mail: bic@catalysis.ru
630090, Россия, Новосибирск, пр-т Ак. Лаврентьева, 5

Тел.: +7 (383) 330-67-71, факс: +7 (383) 330-80-56, E-mail: bic@catalysis.ru
630090, Россия, Новосибирск, пр-т Ак. Лаврентьева, 5
МОДУЛЬНАЯ ПРОГРАММА ЛЕКЦИОННОГО КУРСА, СЕМИНАРОВ И САМОСТОЯТЕЛЬНОЙ РАБОТЫ СТУДЕНТОВ
Методическое пособие, предназначенное для студентов III курса ФЕН специальности «Химия», содержит программу курса лекций в 5-м семестре, структуру курса и правила ИКИ. Кроме того, приведен набор задач для самостоятельной работы студентов (домашних заданий) и даны примеры вариантов промежуточных и экзаменационных контрольных работ за прошлые годы.
Составитель д-р хим. наук, доц. А. А. Хасин
© Новосибирский государственный университет, 2009
Для просмотра web-документов, содержащих формулы, представленные в MathML, и подготовленных указанным выше способом, необходимо наличие на вашем компьютереКонтрольная работа 1 (2008/2009 уч. г.)
Задача 1 (80 баллов)
|
Студент–химик поет песню, вдохнув вместо воздуха He. Используя таблицу, найдите, какая нота звучит вместо ноты “до”. Известно, что скорость звука в газе определяется соотношением
V - мольный объем газа, М -молярная масса газа. Сp воздуха и He равны 29,15 и 20,78 Дж/(моль·К) соответственно. Газы считать идеальными. |
|
Задача 2 (80 баллов)
Найти абсолютную стандартную энтропию твердого аммиака при Т = 15 К, если известно, что при этой температуре cр
= 0.84 Дж/(моль·К), а в диапазоне температур 0-25 К теплоемкость описывается формулой Дебая: c
р=a Т 3.
Задача 3 (80 баллов)
Константа реакции паровой конверсии СО (СО + Н2О -> CO2 + H2)
при 673,3 K составляет 12,24, а при 652,2 K - 15,28. Оцените, при какой температуре должна подаваться в адиабатический аппарат смесь
состава 12 % СО, 5% СО2, 38 % H2, 45 % H2O, чтобы равновесное содержание СО в газе на выходе
из реактора составляло менее 2 %. При оценке можно пренебречь изменением теплоемкости смеси в ходе реакции, Δ
rcp = 0 и полагать сp реакционной смеси равной 33 Дж/(моль К).
Задача 4 (80 баллов)
Углеводород A участвует в двух реакциях, приводящих к получению изомеров В и С:
A = B и A = С.
Значения стандартных энтальпий, энтропий и потенциалов Гиббса образования указанных веществ при
1000 К приведены в таблице
|
Вещество |
Δ fH0 , кДж/моль |
Sf0, Дж/моль·К |
ΔfG 0 , кДж/моль |
|
А (Перилен) |
253,2 |
987,9 |
-734,7 |
Определите равновесный состав при 1000 К. Какой из изомеров будет преобладать при последующем повышении температуры?
Задача 5 (80 баллов)
Оцените коэффициент летучести для метанола при P =30 атм, T =500 K.
P = RT/(V–b) – a/V2, где a = 0,965 м6 Па/моль2; b = 6,7 10–5 м3/моль.
Молярный объем газа при указанных условиях составляет 1,2 л.
Задача 6 (дополнительная, 100 баллов, но при условии, что в сумме не более 400 баллов)
Раздельное окисление СО водяным паром проводят следующим образом. В сосуд, содержащий 2 моля Н2О при 1 атм, помещают
порошок металлического никеля массой 0.01 г, дожидаются окончания всех химических превращений. Затем порошок извлекают из 1–го сосуда и
помещают во второй сосуд, содержащий 1 моль СО при 1 атм, и также дожидаются окончания всех химических превращений. После чего процедуру
повторяют, т. е. порошок периодически приводят в контакт с реагентами в первом и во втором сосудах, где поддерживают постоянную температуру 600 К.
Найти состав смесей в обоих сосудах после 50 повторных циклов. Известны константы равновесия реакций при Т = 600 К:
|
H2O(газ) + Ni(α) = NiO + H2 |
KP1 (600 K) = 1,6. 10– 3 |
Контрольная работа 2 (2008/2009 уч. г.)
Задача 1 (100 баллов)
Зависимости давления насыщенного пара для твердой и жидкой муравьиной кислоты (в мм рт. ст.) от температуры выражаются уравнениями:
Задача 2 (100 баллов)
Известно, что парциальный мольный объем K2SO4 в водном растворе при 25 oC описывается уравнением
где m - моляльность исследуемого раствора. Мольный объем чистой воды при 25 oC примите равным 18,079 см3 моль–1. Определите объем раствора, приготовленного из 1 моля сульфата калия и 1000 граммов воды.
|
Задача 3 (100 баллов) На основании фазовой диаграммы “жидкость - пар” для системы H2O - C4H9OH оцените коэффициенты активности воды в сосуществующих фазах при 350 К. Каким будет давление пара воды над системой, содержащей 3 моля H2O и 2 моля C4H9OH? |
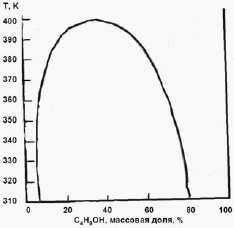
|
Задача 4 (100 баллов)
В индивидуальном состоянии жидкости А и В имеют одинаковые температуры кипения и энтальпии испарения, равные 123,0 oC
и 16,62 кДж/моль соответственно. Жидкости не смешиваются при любом их соотношении. Приготовлена двухфазная смесь с использованием
1 моля жидкости А и 4 молей жидкости В. При какой температуре закипит смесь? Каким будет состав дистиллята?
Задача 5 (100 баллов)
Энтальпия плавления нафталина при нормальной температуре его плавления (80,0 oC) равна 19,29 кДж/моль. При температуре
20 оС проводится эксперимент по приготовлению насыщенного раствора нафталина в гексане. Будет ли получен насыщенный раствор
при добавлении 0,48 моля нафталина к 0,72 моля гексана? Какова вариантность системы, включающей насыщенный раствор и равновесную с ним газовую
фазу?
Задача 6 (дополнительная, 100 баллов, но при условии, что в сумме не более 500 баллов)
На рисунке приведена фазовая диаграмма плавкости для бинарной системы “Pt-Sb”. Назовите равновесные фазы и укажите их число в областях I-IX.
Опишите, что будет происходить с системой при охлаждении расплава с содержанием Sb 45 % от 1400 ºС (точка А) до 550 ºС (точка G).
Каково состояние системы в точках B, C, D, E, F? Как называются точки Н, J, K?
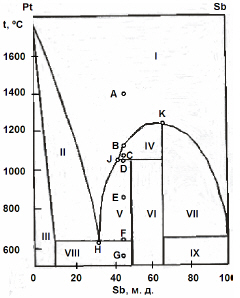
Контрольная работа 3 (2007/2008 уч. г.)
Задача 1 (80 баллов)
Растворимость Ag2CrO4 в воде при 25 oC равна 8.0 10–5 М, а в 0,04 М растворе
NaNO3 - 8,84 10–5 M. Рассчитайте среднеионный коэффициент активности Ag2CrO4 в 0,04 М
растворе NaNO3.
Задача 2 (80 баллов)
Ферментативная цепь дыхания заканчивается цитохромоксидазой, переносящей электроны на активированный кислород. Суммарная реакция
может быть представлена в виде:
2 [cyt с]- + ½
O2 + 2 H+ = 2[cyt с] + H2O,
E0’ (25oC, pH = 7) = + 0,562 В отн. НВЭ
Чему равен стандартный потенциал Гиббса реакции? В какую сторону пойдет реакция при рН = 4 и при pH = 10 на воздухе?
Задача 3 (80 баллов)
Вы находитесь на косе Тузла, разделяющей Черное море (слева) и Азовское море (справа). Рассчитайте разность потенциалов
Елев – Еправ, если для измерения использована а) пара хлор-серебряных электродов, б) пара Na+
селективных электродов. Содержание NaCl в морской воде составляет 18.5 г и 12.0 г на 1 л воды соответственно. Роль солевого моста выполняет
Керченский пролив. Считайте, что минерализация морской воды обеспечивается исключительно хлористым натрием.
Задача 4 (80 баллов)
Железную деталь покрывают краской, состоящей из порошка кадмия. Возможно ли приготовить краску из такого ультрадисперсного порошка кадмия,
при использовании которого не будет происходить коррозионного разрушения детали во влажной среде в присутствии кислорода.
E0(Cd2+/Cd) = - 0,403 В, E0(Fe2+/Fe) = - 0,447 В отн. Н.В.Э.,
ρCd = 8,65 г/см3,
МCd = 112,41 г/моль, σ Cd ≈ 0,8 Дж/м2
Примечание. Коррозия происходит из-за протекания двух полуреакций - анодной Me -> Men+ + ne– и катодной O2 + 4H+ +4e– -> 2H2O (E0 = 1, 23 В отн. Н.В.Э.).
|
Задача 5 (80 баллов) |

|
Известно, что:
Задача 6 (дополнительная, 100 баллов, но при условии, что в сумме не более 400 баллов)
При изучении адсорбции азота, обнаружено, что при T = 273 К и давлении азота 4,5 Торр, масса углеродного сорбента увеличивается по сравнению
с исходной на 22,4 мг, а при давлении 18,6 Торр - на 84,4 мг. Предполагая, что адсорбция следует изотерме Ленгмюра, определите степень заполнения
поверхности сорбента при давлении азота 40 Торр?